吸附-硫化物强化混凝法去除微污染源水中的汞(Ⅱ)
导读::以天然沸石粉、壳聚糖和氢氧化钠为原料制备了新型改性沸石粉吸附材料,采用吸附-硫化物混凝沉淀法,对微污染源水中汞(Ⅱ)的去除进行了研究。考察了吸附时间、pH值、汞(Ⅱ)初始浓度、沸石粉投加量和Na2S投加量等因素对汞(Ⅱ)去除的影响,实验结果表明,pH=8.5,沸石粉投加量为0.4g/L时,汞(Ⅱ)初始浓度为5~7μg/L的源水,经过吸附-硫化物强化混凝法处理后,可使滤后水中汞(Ⅱ))剩余浓度低于1 μg/L。
关键词:改性沸石粉,汞(Ⅱ),微污染源水,吸附,强化混凝
近年来,城市饮用水源水的安全问题,越来越受到人们的关注,尤其针对微污染饮用水源水中的微量重金属的去除,已成为人们关注的热点之一[1-4]。汞是一种毒性很强的重金属元素,在2006年新颁布的《生活饮用水卫生标准》(GB5749-2006)中,汞(II)浓度的限值仍为1mg/L[5],远远低于毒理指标中其他几个重金属的规定限值。汞在天然水体中的存在形态主要是以Hg(II)离子的形式存在,其在强碱性条件下可形成难溶的硫化汞沉淀。传统的硫化物沉淀法便是利用汞的这一特性,通过加碱、强化混凝、沉淀、过滤的方法,可有效去除高浓度含汞废水中的Hg(II)[6]。但是,此法需要在混凝之前投加大量的碱将废水pH值调至10.0以上,并且出水pH值还需回调至7.5~7.8。若将此法用于自来水源水中汞的去除,不但对水厂净水工艺改动很大,且反复加碱和酸,增加了投加化学药剂的成本,加大了整个运行过程的工作强度。同时,较强碱性的水对滤池中石英砂滤料损伤较大,影响滤床寿命,甚至有可能造成滤料板结,影响净水工艺的正常运转。
本文采用改性沸石粉作为吸附剂、聚合氯化铝(PAC)为混凝剂,对微污染源水中的微量汞(II)进行先吸附、后混凝的去除研究,考察了吸附时间、pH值、Hg(II)初始浓度、沸石粉投加量和Na2S投加量等因素对Hg(II)去除的影响。此法应用于微污染水源水中Hg(II)的去除目前鲜见报道,其不仅不需要大量投碱,而且改性沸石粉成本低廉,大大降低了处理费用,在自来水处理应用和应急处置措施上具有一定的指导意义。
1 实验材料和方法
1.1仪器与试剂
(1)仪器:THZ-82A型台式恒温振荡器;ZR4-6型混凝试验搅拌机;101-2-S型电热恒温鼓风干燥箱;pH-3C数显pH计;原子荧光光度计。
(2)材料与试剂:聚合氯化铝(自制,Al2O3=10%,盐基度B=82%),按照文献[7]方法制备。含汞标准贮备液100 mg/L;改性沸石粉,按照文献[8]所述方法制备;氯化汞,氢氧化钠,硫化钠,盐酸等,均为分析纯。
1.2实验方法
(1)吸附阶段:配制浓度为100 mg/L的含汞标准贮备液,并稀释配制成一定浓度的模拟微污染源水,取400 mL于烧杯中,调pH至8.5,加入改性沸石粉,置于混凝搅拌机上,在150r/min的搅拌速度下搅拌吸附一定时间后,再进行混凝处理;
(2)混凝阶段:依次加入一定浓度的Na2S溶液和混凝剂PAC,在250r/min、100r/min、40r/min的搅拌速度下,分别搅拌1.5min、3min、3.5min,静置沉淀10min后,于液面下约1cm处取样,测定。
1.3测定方法
水中Hg(II)的剩余浓度采用原子荧光法测定[9];水样的pH值采用酸度计测定。
2 结果与讨论
2.1交换吸附时间对Hg(II)去除率的影响
采用吸附-混凝法对水中微量Hg(II)进行去除,可充分发挥这两种方法的优势,先藉由吸附剂强大的吸附功能[8]将水中的Hg(II)吸附至表面,再借助混凝剂将水中的吸附剂以及剩余的部分Hg(II)一并去除,使出水达到良好的去除效果。由图1就可明显看出,在相同条件下,先投加吸附剂后投加混凝剂的处理效果明显优于同时投加吸附剂和混凝剂(0min代表同时投加吸附剂和混凝剂),并且随着吸附时间的延长,水中Hg(II)的剩余浓度也随之下降,当吸附时间达到15min时,即可使滤后水中Hg(II)的剩余浓度低于1μg·L-1。
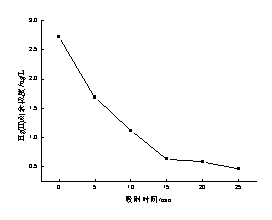
图1吸附时间对Hg (II) 去除率的影响
Fig. 1 Effectof adsorption time on removal of Hg (II)
Hg (II)初始浓度:6.314 μg/L,pH=8.5,改性沸石粉:0.4 g/L,硫化钠:6mg/L(以S计)
2.2 pH值对Hg (II)去除率的影响

图2 pH值对Hg (II)去除率的影响
Fig. 2 Effectof pH value on removal of Hg (II)
Hg (II)初始浓度:5.215 μg/L,吸附15min,改性沸石粉:0.4 g/L,硫化钠:6mg/L(以S计)
以15min作为吸附时间,实验开始前调整源水pH值为设定值,其他操作不变,考察不同pH值对Hg (II)去除的影响,结果如图2所示。由图2可知,无论是采用单独的硫化物沉淀法,还是吸附-硫化物混凝沉淀法处理,源水中Hg (II)的剩余浓度随着pH值的升高而降低环境保护,但是采用单独的硫化物沉淀法时,滤后水中的Hg (II)剩余浓度始终不能满足饮用水卫生标准的要求。而与吸附法联合之后,水中Hg (II)的剩余浓度大大下降,当pH升至8.5左右时,即可使滤后水中Hg (II)的浓度低于1μg/L。这是因为,在中性至弱碱性条件下,即7.0≤pH≤8.0时,Hg2+不易水解生成Hg(OH)2,并且此pH值条件下,S2-比较难与Hg2+结合生成硫化汞,此时主要通过改性沸石粉的吸附能力去除Hg (II),因而滤后水中的Hg (II)未达到饮用水标准。当pH≥8.5时,未被吸附的Hg2+发生水解生成Hg(OH)2,同时S2-与Hg2+结合生成硫化汞沉淀,这些物质都会在后续的混凝沉淀中较容易的沉淀去处,因此可使滤后水中的Hg (II)进一步降低,达到饮用水标准以下。
2.3 改性沸石粉投加量对Hg (II)去除率的影响

图3改性沸石粉投加量对Hg (II)去除率的影响
Fig. 3 Effectof modified zeolite powder dosageson removal of Hg(II)
Hg (II)初始浓度:5.612 μg/L,pH=8.5,吸附15min,硫化钠:6mg/L(以S计)
利用壳聚糖和氢氧化钠对天然沸石粉进行改性制得的改性沸石粉,其形貌结构由原来大小不一、形状各异的团状结构转变成了孔隙状结构,且壳聚糖负载于其上,形成了内比表面积更大的多孔物质,具有超强的吸附能力[8]。并且,壳聚糖分子中的活性基团如-NH2、-OH等可与重金属离子发生螯合作用而将其吸附其上[10,11]。改性沸石粉投加量对Hg (II)去除的影响见图3。
由图3可知,随着吸附剂投加量的增加,Hg (II)的去除率也增加,这是因为吸附剂投加量的增大提供了更多的吸附活性点位。当投加量大于0.4g/L时,滤后水即可达到饮用水标准。
2.4 S2-浓度对Hg (II)去除率的影响

图4 S2-浓度对Hg (II)去除率的影响
Fig. 4 Effectof S2- concentration onremoval of Hg(II)
Hg (II)初始浓度:5.412 μg/L,pH=8.5,吸附15min,改性沸石粉:0.4 g/L
由图4可知,随着S2-浓度的增加,Hg (II)的剩余浓度不断下降,当其浓度为6 μg/L时,滤后水中Hg (II)的剩余浓度即在1 μg/L以下。由于在吸附阶段,源水中部分Hg (II)已被改性沸石粉吸附于其表面,因此只需投加少量的Na2S即可达到出水标准。并且,饮用水标准中规定硫化物含量不得超过0.02mg/L,由于在我们的实验中,投加Na2S的量远低于此限值,故不用测定源水中残余硫的量。
2.5 混凝剂投加量对Hg (II)去除率的影响
投入水中的吸附剂能否很好的与水分离,直接关系到出水的水质是否达标。混凝剂的投加可强化吸附剂的沉淀作用,同时也能混凝沉淀一部分Hg (II)。由图5可知,随着PAC投加量的增加,滤后水中Hg (II)的剩余浓度迅速下降,当投加量大于5 mg/L时环境保护,出水即可达到饮用水标准。

图5 混凝剂投加量对Hg (II)去除率的影响
Fig. 5 Effectof coagulantdosage on removal of Hg (II)
Hg (II)初始浓度:5.412 μg/L,pH=8.5,吸附15min,改性沸石粉:0.4 g/L,硫化钠:6 mg/L(以S计)
2.6 Hg (II)初始浓度对其去除率的影响
取不同Hg (II)质量浓度的原水400mL,按上述的实验方法(1.2),测定其对Hg (II)剩余浓度的影响,结果见图6。

图6 Hg (II)初始浓度对Hg (II)去除的影响
Fig. 6 Effectof initial concentration of Hg (II)on removal of Hg(II)
pH=8.5,吸附15min, 沸石粉投加量0.4g,NaS浓度6μg/L(以S计)
由图6可知,随着Hg (II)初始浓度的增加,滤后水中Hg(II)的浓度也在不断上升。这是因为在吸附剂投量不变的情况下,所提供的活性吸附点位的数目也是一定的,其达到吸附平衡时能够吸附的Hg (II)的量也是一定的,因此剩余Hg (II)的浓度随着Hg (II)初始浓度的增大而增大。当Hg(II)浓度在3~7μg/L的范围内时,投加0.4 g/L的沸石粉和6 μg/L 的Na2S即可使出水达到饮用水标准。而当浓度大于7μg/L甚至遇到突发污染事故浓度更高时,可采取增大改性沸石粉投加量以及Na2S浓度来降低滤后水的Hg (II)剩余浓度。
3 结论
(1)单独的硫化物沉淀法难以有效的去除Hg (II),即使将pH值调至11。仍无法使滤后水中剩余Hg (II)浓度达到饮用水标准。
(2)通过吸附和混凝两种方法的有机结合,克服了单纯硫化物沉淀法反复投加碱和酸调整pH值的缺点,并可在接近中性的pH条件下使出水达到饮用水标准,此方法无需对净水工艺进行改动,易于实现。
(3)考察了吸附时间、pH值、沸石粉投加量、Na2S浓度、混凝剂投加量、Hg (II)初始浓度等因素对Hg (II)去除的影响,结果均表明,此法可以有效去除微污染源水中的Hg (II),达到《生活饮用水卫生标准》(GB5749—2006)的要求。
参考文献
[1]姚娟娟,高乃云,刘成,等.砷污染原水的应急处理工艺研究.中国给水排水,2007,23(21):15-23
[2]李明玉,林达红,任刚,等.改性沸石粉去除微污染水源水中镉(Ⅱ)的试验研究.中国给水排水,2008,24(17):79-83
[3]陈伟玲,李明玉,任刚,等.强化混凝去除微污染水源水中镉(II)的研究. 给水排水,2008,34(11):129-132
[4]张晓健.松花江和北江水污染事件中的城市供水应急处理技术.给水排水,2006,32(6):6-12
[5]中华人民共和国卫生部中国标准化管理委员会.GB5749-2006 生活饮用水卫生标准. 北京:中国标准出版社,2007
[6]吴秀英,吴农忠,赵宏远,等.硫化钠处理含汞废水.中国环境科学,1995,15(2):128~130
[7]董申伟,李明玉,陈伟红,等.聚合氯化铝的盐基度与混凝性能关系研究.工业水处理,2007,27(2):53-56
[8]李明玉,林达红,任刚,等.改性沸石粉去除微污染水源水中镉(II)的试验研究. 中国给水排水,2008,24(17):79-83
[9]中华人民共和国国家标准.GB/T5750.6-2006水质汞的测定 原子荧光法. 北京:中国标准出版社, 2007[10] 李增新,王国明,张道来,等.天然沸石粉负载壳聚糖吸附溶液中镉(Ⅱ)的研究. 安全与环境学报,2007,7(2):43-45
[11]张娜,张雯,殷玥.壳聚糖复合絮凝剂在工业污水处理中的应用研究.化工时刊,2006,20(11):35-36

使用微信“扫一扫”功能添加“谷腾环保网”








