电渗析工艺进水钙离子究竟要控制在多少以下呢?
中水回用、废水零排放中,废水的浓缩减量,往往会涉及到钙盐的结垢问题。
针对于电渗析工艺,进水钙离子究竟要控制在多少以下呢?
以硫酸钙系统为例:
资料01 硫酸钙的结垢
在工业废水的处理中,碳酸盐、磷酸盐、硫酸盐都是比较常见的结垢成分,碳酸盐和磷酸盐一定程度上可以通过酸来调控,而硫酸钙垢往往致密坚硬且酸碱难溶,在膜浓缩过程中很不受待见。
最常规理解:如果系统产生硫酸钙结垢,废水中其硫酸钙溶液浓度已过饱和。在这类系统的测算中,免不了需要了解物质的溶解度及其影响因素。
结晶过程的产生取决于固体与其溶液之间的平衡关系,溶质从溶液中结晶出来,正常都涉及到两个过程:晶核的产生和晶体的生长。溶液的过饱和度与结晶存在以下的关系:
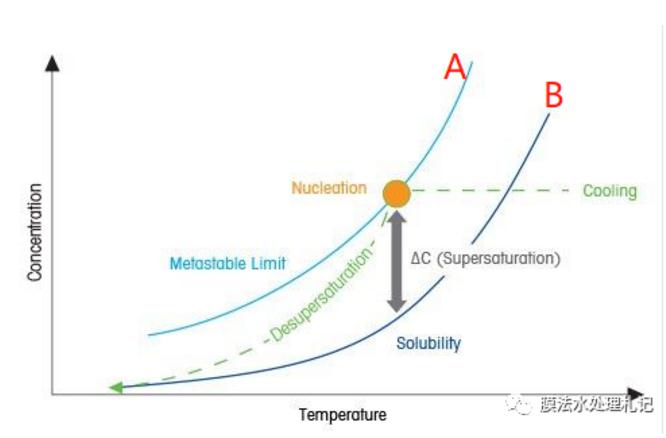
曲线B:物质溶解度曲线;B曲线以下,属于稳定区,不存在结晶问题。
曲线A:超溶解度曲线;A曲线以上,属于不稳定区,溶液能自发的产生晶核,并伴随晶体生长。
曲线A和B之间其实还存在一个介稳区,溶液也处于过饱和状态,但是由于无法自发形成晶核,所以还不会产生晶体。
不难理解,B曲线很容易得到,那A曲线可以怎么得到呢?按我的理解,上图可以给我们一些答案:B曲线条件下,缓慢降低温度,有晶体析出时,即可找到对应的A曲线对应的点。
在实际过程中,超溶解度曲线的绘制往往会更加复杂一些。基于这些特点,电渗析系统中硫酸钙的结垢问题是否也需要多角度考虑?
综合膜行业朋友的各类反馈:超溶解度曲线对ED而言,意义不明显,目前均以B曲线参考为主,测算硫酸钙的溶度积。
部分可参考性解释如下:1.介稳区的区间有限,电渗析存在温升,无法实现精度控制,而且也没有必要;2. 电渗析迁移过程,膜表面与隔室间溶液存在浓度差,并非一个完全均一的溶液系统;3. 电渗析存在倒极功能,一定条件下的高频电场可以产生静电斥力、抑制晶体生长速率;4.工业水硫酸盐系统大多为混盐,无法得到唯一的参考曲线。
资料02 几个重要的概念
在进行硫酸钙系统沉淀、溶解等平衡测算时,主要涉及到混合溶液中其它离子对溶解度的影响,这里需要重新回忆大学无机化学的几个概念:
离子活度:离子实际发挥作用的浓度称为有效浓度,或称为活度。即有时候结垢的阴阳离子没有想象的那么容易“碰面”。
离子强度:离子强度是衡量溶液中存在离子所产生的电场强度的量度,水溶液中电解质的浓度会影响到其他盐类的溶解度,而影响的强弱程度就称为离子强度。
离子积和溶度积常数:前者大,析出沉淀;后者大,无沉淀析出;两者相等,溶液饱和。
测算时,可参考的公式如下:

其中硫酸钙在25℃条件下,溶度积KSP'常数与离子强度的参考曲线:
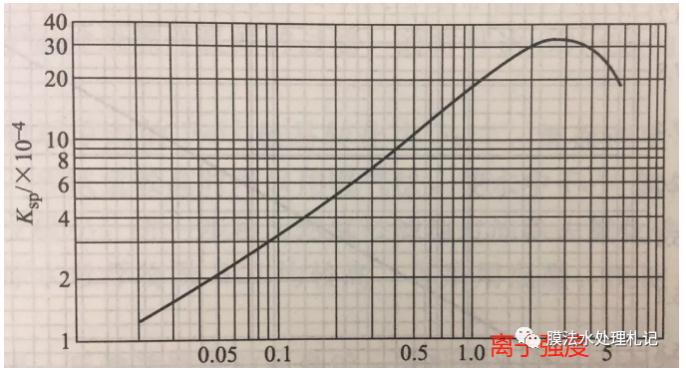
虽然上述3.2德拜-休克尔公式有应用前提条件,但以公式为基础,硫酸钙的KSP'常数与离子强度的关系曲线就不难理解。在低浓度时,溶解度随离子强度增大,活度系数降低,故而硫酸钙溶解度增加,在高盐浓度况下,硫酸钙形成离子对,短程静电相互作用增强,使溶解度降低。
在实际的ED工艺测算中,含硫酸钙的废水系统,测算过程相对简单化:1. 根据工艺要求,设定浓缩倍数,测算出浓水水质;2. 以浓水数据,测算出系统的浓水离子强度;3. 以离子强度数据为基础,根据曲线得到浓水硫酸钙的KSP'常数;3. 根据离子浓度,计算出硫酸钙的离子积常数;4. 基于上述参数,核对工艺参数设定是否合理?进水Ca离子是否满足要求?
资料03 案例测算说明

(1) 电渗析初步按浓水TDS=180g/L考虑,浓缩倍数约5.47倍;
(2) 测算出此条件下的浓水水质,再求离子强度=2.88mol/L(按公式3.3计算即可);
(3) 得到浓水硫酸钙KSP'常数=31.2*10^(-4),查图即可;
(4) 浓水硫酸钙离子积常数=4.67*10^(-4),按公式计算;
(5) 为了提高稳定性,浓水最终按0.8ksp'考虑;
(6) 即满足浓水离子积常数<0.8浓水KSP'常数,系统结垢风险极低。
一套流程下来,测算的过程是否与RO设计思路类似?
显然在这类系统中,前期的评估我们更多地只考虑了盐效应的影响,硫酸钙的结垢对电渗析而言,系统还可以通过添加阻垢剂、高频的倒极、单价选择膜的选型、设备的拆洗等方式进行应对。此外,由于硫酸钙的沉淀优先在阴膜表面产生,所以阴膜性能的优化也是一个选择,组器的设计更是如此。
综合上述简易分析,不难理解,对于电渗析进水钙离子而言,几十ppm、几百ppm、几千ppm的系统,也未尝不可处理,关键还是水质特性和处理目标。

使用微信“扫一扫”功能添加“谷腾环保网”









